免疫共沉淀(Co-immunoprecipitation)是以抗体和抗原之间的专一性作用为基础的,用于研究蛋白质间相互作用的经典方法,是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。这种方法常用于测定两种目标蛋白质是否在体内结合;也可用于确定一种特定蛋白质的新的作用搭档。
免疫沉淀
利用抗原抗体特异性结合,在含有目的抗原的细胞裂解液中加入特定的抗体以及Protein A-Beads ,根据抗原与抗体、Protein A与抗体的FC的特异性,形成“抗原-抗体-Protein A-Beads”的复合物,清洗离心后去除溶液中未结合的杂蛋白,得到目的蛋白之后,用SDS-PAGE和Western blot进行验证。
免疫共沉淀
基于免疫沉淀的反应,捕获和纯化靶蛋白(即抗原)以及样品溶液中与靶蛋白天然相互作用结合的其他大分子。因此实验属于IP还是Co-IP取决于实验的目的是目的抗原还是相互作用大分子。
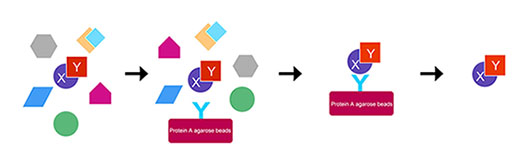
免疫共沉淀实验的优化
免疫共沉淀的操作方法较为简单,但由于生理状态下蛋白间的相互作用 可能存在非特异性结合,或是存在抗体的污染,因此有以下几个方面可以进行优化。
裂解和洗涤缓冲液
裂解和洗涤缓冲液是维持复合物形成的关键因素。使用标准非变性裂解缓冲液裂解,许多蛋白间的相互作用将保持完整。含有非离子型洗涤剂的低离子强度缓冲液(即<120mM NaCl)不太可能破坏蛋白间的相互作用。另外应避免在洗涤期间用超声或涡旋处理的方法裂解细胞、裂解物或珠子结合的免疫复合物,以防止破坏复合物间的相互作用。离心过程中应轻柔处理样品以确保减少复合物的损失。
固相支持物的选择
用于免疫共沉淀的固相支持物一般有琼脂糖珠和磁珠两种。琼脂糖珠由于其多孔表面通常具有更高的结合能力,磁珠能提供诸如易于使用,更低的非特异性结合和与自动化的兼容性等优点。更多的比较可以详见免疫沉淀技术页面。
非特异性作用的高背景
由于细胞裂解物中存在大量蛋白质,因此在操作过程中可能会发生与目标复合物的非特异性结合。这些非特异性相互作用一般通过彻底清洗珠子结合的免疫复合物来打破,但也可以应用其他策略来优化非特异性结合,例如:
- 通过将盐浓度从120mM滴定至1000mM来改变缓冲液的离子强度
- 减少一抗的使用量,直到信号干扰比最大化
- 预清除裂解物
抗体污染的解决
免疫共沉淀常遇到的问题是在凝胶分析期间来自抗体条带的干扰。在沉淀的样品中可能会存在抗体轻链(25KD)和重链(50KD)的干扰。针对这种情况可以采用以下几种方法进行优化:
- 运用交联剂将抗体和Protein A-Beads交联,通过添加不含巯基乙醇的加样缓冲液处理目的蛋白-抗体- Protein A-beads复合物,最后离心去除抗体-Protein A-beads复合物,上清中只留下目的蛋白
- 利用生物素化抗体和链霉亲和素微珠直接偶联。免疫复合物被珠子捕获,并且因为生物素与链霉抗生物素蛋白强烈结合,当使用温和条件释放靶抗原时抗体不会从珠子上洗脱
- 将常用的融合标签掺入用于Co-IP主要靶蛋白中时,预固定的抗融合标签抗体可用于蛋白质复合物纯化
如何评估蛋白间的相互作用
在检测蛋白间的相互作用时,需要判断检测是真正的生理相互作用还是由于方案原因导致产生的相互作用。以下是几种判断标准:
验证抗体特异性
- 通过免疫沉淀来进行抗体验证,然后进行质谱分析,也可以识别先前已知的蛋白间的相互作用
- 根据已知特异性结合靶蛋白的充分表征的抗体,来确定检测到的蛋白相互作用中的靶蛋白可以从样品中被沉淀。在测试未表征的抗体时,应设置对照以显示使用测试抗体可以从纯化蛋白质的原液中沉淀靶蛋白
即使是高质量的单克隆抗体也可能与非特异性蛋白结合,因此在实验时尽可能使用与一抗相匹配的对照抗体。
验证功能交互
许多蛋白间的相互作用依赖于复合物中一种或多种结合配偶体的活化。因此为了测试是否发生真正的相互作用,表达其中一个结合配偶体的无活性变体的细胞可用于蛋白质复合物的Co-IP。如果需要活化,则复合物不会与靶抗原发生共沉淀。
确认生理相互作用
细胞裂解导致不存在相互作用的蛋白质检可能会发生结合(况且有一些蛋白之间必不可少的会发生结合)。为了是否是此种情况,可以标记细胞中的所有蛋白质,然后用裂解缓冲液裂解细胞,裂解缓冲液包括未标记的目的蛋白。因为这种未标记的蛋白不能与通过co-IP回收的用于复合物形成的放射性标记的蛋白竞争。因此,可得出结论是否为正常生理状态下的相互作用。
